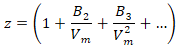Compressibilité des gaz
Sommaire de la page:
Connaitre précisément la masse volumique d'un gaz est
important pour calculer le débit passant dans une tuyauterie, une
vanne, une soupape, et pour tous les échanges commerciaux. Les
équipements de mesure de débit ont besoin de cette information pour
traduire en masse les indications relevées.
Les gaz sont des fluides compressibles. C'est ce qui les
différencie des liquides. Le volume qu'ils occupent dépend de nombreux
facteurs.
Equation d'état des gaz
Le volume qu'un gaz occupe dépend de:
- le nombre de moles de substance présente
- la température du gaz
- la pression du gaz

z : Coefficient de compressibilité
n : Nombre de moles de gaz
P: Pression absolue du gaz
T : Température absolue du gaz (K)
V : Volume de gaz
R : Constante des gaz parfaits
La relation entre ces différents paramètres est une
équation d'état, c'est-à-dire qu'elle décrit l'état du gaz, quelle que
soit la manière utilisée pour y parvenir.
La relation pour un gaz parfait est souvent appelée loi de Mariotte (ou
loi de Boyle dans les pays anglo-saxons) bien que Edme Mariotte en 1676
ne tenait compte ni de la température ni du nombre de moles de gaz.
Le comportement des gaz s'écartant de la loi de Mariotte,
lorsque les conditions s'éloignent de la pression atmosphérique et de
la température ambiante, un facteur correctif "z" est introduit dans la
relation pour représenter les gaz réels.
z
est appelé facteur de compressibilité. Il dépend de la nature de la
substance, de la température et de la pression.
Si la valeur de z est égale à 1, le gaz est dit suivre la loi des gaz parfaits et l'équation d'état devient simplement PV=nRT. C'est le cas de la plupart des gaz considérés à des températures et pressions proches des conditions normales.
Si la valeur de z diffère de 1, le gaz est dit suivre la loi des gaz réels. Il devient nécessaire de déterminer z pour tout calcul volumique du gaz.
Coefficient de compressibilité (z)
Sa valeur n'est pas une constante d'un gaz, elle dépend également des conditions opératoires (température et pression). Aussi il doit être déterminé pour chaque étape d'un processus.De nombreux scientifiques on cherché une relation permettant de calculer précisément ce facteur, donnant naissance à de nombreuses variantes de l'équation d'état d'un gaz.
Diagramme universel
Diagramme universel de Nelson et Obert
 publié en 1954 un tel diagramme est le fruit de la compilation de données pour 26 gaz différents
publié en 1954 un tel diagramme est le fruit de la compilation de données pour 26 gaz différents
Selon les observations de Van der Waals, le facteur de
compressibilité de tous les gaz présente le même écart à la normalité
d'un gaz parfait, quand pression et température sont exprimées par leur
valeur réduite (Pr = P/Pc et Tr = T/Tc).
Le coefficient de compressibilité peut
alors être lu sur des diagrammes dit "universels" tracés en
coordonnées réduite, et utilisables pour toute une gamme de gaz.
Nelson et Obert ont publié en 1954 un tel diagramme qui est le fruit de
la compilation de données pour 26 gaz différents.
Equation de Van der Waals
P: Pression absolue du gaz
T : Température absolue du gaz (K)
Vm: volume molaire du gaz
R: constante des gaz parfaits
- "a" fonction de la taille des molécules
- et "b" de l'interaction entre elles.
Les résultats sont en accord avec le diagramme de Nelson et Obert à 5% près, tant que Pr reste ≤ Tr
| Formule | Nom | a Pa.m6/mol2 | b 10-3m3/mol |
|---|---|---|---|
| AlCl3 | Aluminum trichloride | 4,263 | 0,245 |
| NH3 | Ammonia | 0,4225 | 0,03713 |
| NH4Cl | Ammonium chloride | 0,238 | 0,00734 |
| Ar | Argon | 0,1355 | 0,03201 |
| BCl3 | Boron trichloride | 1,56 | 0,1222 |
| BF3 | Boron trifluoride | 0,398 | 0,05443 |
| B2H6 | Diborane | 0,6048 | 0,07437 |
| Br2 | Bromine | 0,975 | 0,0591 |
| ClFO2 | Perchloryl fluoride | 0,7371 | 0,0713 |
| ClF5 | Chlorine pentafluoride | 0,958 | 0,08204 |
| ClH4P | Phosphonium chloride | 0,4111 | 0,04545 |
| Cl2 | Chlorine | 0,6343 | 0,05422 |
| Cl3FSi | Trichlorofluorosilane | 1,567 | 0,1273 |
| F2 | Fluorine | 0,1171 | 0,02896 |
| GeCl4 | Germanium tetrachloride | 2,312 | 0,1489 |
| F3N | Nitrogen trifluoride | 0,358 | 0,05453 |
| F3P | Phosphorus trifluoride | 0,4954 | 0,0651 |
| F4N2 | Tetrafluorohydrazine | 0,7426 | 0,08564 |
| GeH4 | Germane | 0,5743 | 0,06555 |
| He | Helium | 0,00346 | 0,0238 |
| HBr | Hydrogen bromide | 0,45 | 0,04415 |
| HCl | Hydrogen chloride | 0,37 | 0,04061 |
| HCN | Hydrogen cyanide | 1,129 | 0,08806 |
| HF | Hydrogen fluoride | 0,9565 | 0,0739 |
| HI | Hydrogen iodide | 0,6309 | 0,05303 |
| H2 | Hydrogen | 0,02453 | 0,02651 |
| H2O | Water | 0,5537 | 0,03049 |
| H2S | Hydrogen sulphide | 0,4544 | 0,04339 |
| H2Se | Hydrogen selenide | 0,5523 | 0,0479 |
| Kr | Krypton | 0,2325 | 0,0396 |
| SiH4 | Silane | 0,438 | 0,0579 |
| SiCl4 | Silicon tetrachloride | 2,096 | 0,147 |
| SiF4 | Silicon tetrafluoride | 0,5259 | 0,07236 |
| TiCl4 | Titanium(IV) chloride | 2,547 | 0,1423 |
| Hg | Mercury | 0,5193 | 0,01057 |
| NO | Nitric oxide | 0,146 | 0,0289 |
| NO2 | Nitrogen dioxide | 0,536 | 0,0443 |
| N2 | Nitrogen | 0,137 | 0,0387 |
| N2O | Nitrous oxide | 0,3852 | 0,04435 |
| N2H4 | Hydrazine | 0,846 | 0,0462 |
| Ne | Neon | 0,0208 | 0,01672 |
| O2 | Oxygen | 0,1382 | 0,03186 |
| O3 | Ozone | 0,357 | 0,0487 |
| P | Phosphorus | 5,36 | 0,157 |
| PH3 | Phosphine | 0,4696 | 0,05157 |
| Rn | Radon | 0,6601 | 0,06239 |
| SnCl4 | Stannic chloride | 2,725 | 0,1641 |
| S | Sulphur | 2,43 | 0,066 |
| SO2 | Sulphur dioxide | 0,6865 | 0,05679 |
| SF6 | Sulphur hexafluoride | 0,7857 | 0,08786 |
| Se | Selenium | 3,34 | 0,0675 |
| UF6 | Uranium(VI) fluoride | 1,601 | 0,1128 |
| WF6 | Tungsten(VI) fluoride | 1,325 | 0,1063 |
| Xe | Xenon | 0,4192 | 0,05156 |
| XeF2 | Xenon difluoride | 1,246 | 0,07037 |
| XeF4 | Xenon tetrafluoride | 1,552 | 0,09035 |
| CClF3 | Chlorotrifluoromethane | 0,6873 | 0,0811 |
| CCl3F | Trichlorofluoromethane | 1,468 | 0,1111 |
| CCl4 | Tetrachloromethane | 2,001 | 0,1281 |
| CF4 | Tetrafluoromethane | 0,404 | 0,06325 |
| CO | Carbon monoxide | 0,1472 | 0,03948 |
| COS | Carbon oxysulphide | 0,6975 | 0,06628 |
| CO2 | Carbon dioxide | 0,3658 | 0,04286 |
| CS2 | Carbon disulphide | 1,125 | 0,07262 |
| CHCl3 | Trichloromethane | 1,534 | 0,1019 |
| CHF3 | Trifluoromethane | 0,5378 | 0,06403 |
| CH2Cl2 | Dichloromethane | 1,244 | 0,08689 |
| CH2F2 | Difluoromethane | 0,6184 | 0,06268 |
| CH3Cl | Chloromethane | 0,7566 | 0,06477 |
| CH3F | Fluoromethane | 0,5009 | 0,05617 |
| NH3NO2 | Nitromethane | 1,718 | 0,1041 |
| CH4 | Methane | 0,23 | 0,04301 |
| CH3OH | Methanol | 0,9472 | 0,06584 |
| CH3SH | Methanethiol | 0,8911 | 0,06756 |
| CH3NH2 | Methylamine | 0,7106 | 0,05879 |
| C2Cl2F3 | 1,1,2-Trichlorotrifluoroethane | 2,025 | 0,1481 |
| C2F4 | Tetrafluoroethylene | 0,6954 | 0,08085 |
| C2N2 | Cyanogen | 0,7803 | 0,6952 |
| C2H2 | Acetylene | 0,4516 | 0,0522 |
| C2H2F2 | 1,1-Difluoroethylene | 0,6 | 0,07058 |
| C2H3Cl3 | 1,1,1-Trichloroethane | 2,015 | 0,1317 |
| C2H3F | Fluroethylene | 0,5984 | 0,06504 |
| C2H3F3 | 1,1,1-Trifluoroethane | 0,9302 | 0,09572 |
| C2H3N | Acetonitrile | 1,789 | 0,1169 |
| C2H4 | Ethylene | 0,4612 | 0,05821 |
| C2H4Cl2 | 1,1-Dichloroethane | 1,573 | 0,1072 |
| C2H4Cl2 | 1,2-Dichloroethane | 1,7 | 0,108 |
| C2H4O | Ethylene oxide | 0,8922 | 0,06779 |
| CH3COOH | Acetic acid | 1,771 | 0,1065 |
| C2H4O2 | Methyl formate | 1,154 | 0,08442 |
| C2H5Br | Bromoethane | 1,189 | 0,08406 |
| C2H5Cl | Chloroethane | 1,17 | 0,09 |
| C2H5F | Fluoroethane | 0,817 | 0,07758 |
| C2H6 | Ethane | 0,557 | 0,06499 |
| C2H6O | Dimethyl ether | 0,869 | 0,07742 |
| C2H5OH | Ethanol | 1,256 | 0,0871 |
| C2H5SH | Dimethyl sulphide | 1,334 | 0,09453 |
| C2H5SH | Ethanethiol | 1,323 | 0,09447 |
| C2H7N | Dimethylamine | 1,044 | 0,0851 |
| C2H7N | Ethylamine | 1,079 | 0,08433 |
| C3F8 | Perfluoropropane | 1,296 | 0,1338 |
| C3H5N | Propanenitrile | 2,157 | 0,1369 |
| C3H6 | Propene | 0,8438 | 0,08242 |
| C3H6 | Cyclopropane | 0,8293 | 0,0742 |
| C3H6O | Acetone | 1,602 | 0,1124 |
| C3H6O | Propanal | 1,408 | 0,09947 |
| C3H6O2 | Ethyl formate | 1,591 | 0,1115 |
| C3H6O2 | Methyl acetate | 1,575 | 0,1108 |
| C3H6O2 | Propanoic acid | 2,349 | 0,1386 |
| C3H7Cl | 1-Chloropropane | 1,611 | 0,1141` |
| C3H8 | Propane | 0,9385 | 0,09044 |
| C3H8O | 1-Propanol | 1,626 | 0,108 |
| C3H8O | 2-Propanol | 1,582 | 0,1109 |
| C3H8O | Ethyl methyl ether | 1,27 | 0,1034 |
| C3H8S | Ethyl methyl sulphide | 1,945 | 0,13 |
| C3H9N | Propylamine | 1,526 | 0,1094 |
| C3H9N | Trimethylamine | 1,337 | 0,1101 |
| C4H4O | Furan | 1,274 | 0,0926 |
| C4H4S | Thiophene | 1,721 | 0,1058 |
| C4H4N | Pyrrole | 1,882 | 0,1049 |
| C4H6 | 1,3-Butadiene | 1,217 | 0,102 |
| C4H6O3 | Acetic anhydride | 2,68 | 0,157 |
| C4H7N | Butanenitrile | 2,576 | 0,1568 |
| C4H8 | 1-Butene | 1,276 | 0,1084 |
| C4H8 | Cyclobutane | 1,239 | 0,096 |
| C4H8O | 2-Butanone | 1,997 | 0,1326 |
| C4H8O | Tetrahydrofuran | 1,639 | 0,1082 |
| C4H8O2 | 1,4-Dioxane | 1,929 | 0,1171 |
| C4H8O2 | Ethyl acetate | 2,057 | 0,1401 |
| C4H8O2 | Methyl propanoate | 2,051 | 0,1377 |
| C4H8O2 | Propyl formate | 2,079 | 0,1377 |
| C4H8O2 | Butanoic acid | 2,818 | 0,1609 |
| C4H9N | Pyrrolidine | 1,684 | 0,1056 |
| C4H10 | Butane | 1,393 | 0,1168 |
| C4H10 | Isobutane | 1,336 | 0,1168 |
| C4H10O | 1-Butanol | 2,09 | 0,1323 |
| C4H10O | 2-Methyl-2-propanol | 1,881 | 0,1324 |
| C4H10O | 2-Methyl-1-propanol | 2,035 | 0,1324 |
| C4H10O | Diethyl ether | 1,746 | 0,1333 |
| C4H10S | Diethyl sulphide | 2,285 | 0,1462 |
| C4H11N | Butylamine | 1,941 | 0,1301 |
| C4H11N | Diethylamine | 1,94 | 0,1383 |
| C4H12Si | Tetramethylsilane | 2,081 | 0,1653 |
| C5H4O2 | Furfural | 2,223 | 0,1182 |
| C5H5N | Pyridine | 1,977 | 0,1137 |
| C5H8 | Cyclopentene | 1,561 | 0,1097 |
| C5H10 | 1-Pentene | 1,786 | 0,137 |
| C5H10 | 2-Methyl-1-butene | 1,69 | 0,129 |
| C5H10 | 2-Methyl-2-butene | 1,726 | 0,1279 |
| C5H10 | Cyclopentane | 1,694 | 0,118 |
| C5H10O | Tetrahydropyran | 2,002 | 0,1247 |
| C5H10O2 | Isobutyl formate | 2,282 | 0,1476 |
| C5H10O2 | Propyl acetate | 2,623 | 0,17 |
| C5H10O2 | Ethyl propanoate | 2,586 | 0,1688 |
| C5H10O2 | Methyl butanoate | 2,583 | 0,1661 |
| C5H10O2 | Methyl isobutanoate | 2,487 | 0,1639 |
| C5H11N | Piperidine | 2,084 | 0,125 |
| C5H12 | Pentane | 1,913 | 0,1451 |
| C5H12 | Isopentane | 1,829 | 0,1415 |
| C5H12 | Neopentane | 1,717 | 0,141 |
| C5H12O | 1-Pentanol | 2,581 | 0,1564 |
| C6H5Br | Bromobenzene | 2,896 | 0,1541 |
| C6H5Cl | Chlorobenzene | 2,58 | 0,1454 |
| C6H5F | Fluorobenzene | 2,01 | 0,1279 |
| C6H5I | Iodobenzene | 3,354 | 0,1658 |
| C6H6 | Benzene | 1,882 | 0,1193 |
| C6H5OH | Phenol | 2,293 | 0,1177 |
| C6H5NH2 | Aniline | 2,914 | 0,1486 |
| C6H10O | Cyclohexanone | 3,11 | 0,17 |
| C6H11N | Hexanenitrile | 3,55 | 0,1996 |
| C6H12 | Cyclohexane | 2,195 | 0,1413 |
| C6H11OH | Cyclohexanol | 2,893 | 0,1586 |
| C6H12O2 | Pentyl formate | 2,797 | 0,173 |
| C6H12O2 | Isobutyl acetate | 2,905 | 0,1845 |
| C6H12O2 | Ethyl butanoate | 3,053 | 0,1922 |
| C6H12O2 | Ethyl 2-methylpropanoate | 2,905 | 0,1872 |
| C6H12O2 | Methyl pentanoate | 2,939 | 0,1847 |
| C6H14 | Hexane | 2,497 | 0,1753 |
| C6H14 | 2,3-Dimethylbutane | 2,329 | 0,166 |
| C6H14O | 1-Hexanol | 3,135 | 0,1829 |
| C6H15N | Triethylamine | 2,759 | 0,1836 |
| C6H15N | Dipropylamine | 2,482 | 0,1591 |
| C7H5N | Benzonitrile | 3,389 | 0,1727 |
| C7H6O | Benzaldehyde | 3,03 | 0,1553 |
| C7H8 | Toluene | 2,489 | 0,1499 |
| C7H8O | o-Cresol | 2,833 | 0,1447 |
| C7H8O | m-Cresol | 3,186 | 0,1609 |
| C7H8O | p-Cresol | 2,811 | 0,1422 |
| C7H8O | Benzyl alcohol | 3,47 | 0,173 |
| C7H8O | Anisole | 2,86 | 0,1579 |
| C7H16 | Heptane | 3,089 | 0,2038 |
| C7H15OH | Heptanol | 3,722 | 0,2097 |
| C8H10 | Ethylbenzene | 3,086 | 0,1782 |
| C8H10 | o-Xylene | 3,106 | 0,1756 |
| C8H10 | m-Xylene | 3,141 | 0,1814 |
| C8H10 | p-Xylene | 3,154 | 0,1824 |
| C8H10O | Phenetole | 3,57 | 0,1966 |
| C8H11N | N,N-Dimethylaniline | 3,792 | 0,1967 |
| C8H18 | Octane | 3,786 | 0,2372 |
| C8H18 | 2,5-Dimethylhexane | 3,549 | 0,2299 |
| C8H18O | 1-Octanol | 4,342 | 0,2371 |
| C9H7N | Quinoline | 3,67 | 0,1672 |
| C9H12 | Cumene | 3,62 | 0,2044 |
| C9H12 | Propylbenzene | 3,714 | 0,2073 |
| C9H12 | 1,2,4-Trimethylbenzene | 3,803 | 0,2088 |
| C9H12 | Mesitylene | 3,787 | 0,2118 |
| C9H20 | Nonane | 4,511 | 0,2702 |
| C9H20O | 1-Nonanol | 5 | 0,2654 |
| C10H8 | Naphthalene | 4,032 | 0,192 |
| C10H14 | Butylbenzene | 4,407 | 0,2378 |
| C10H14 | Isobutylbenzene | 4,04 | 0,2215 |
| C10H14 | o-Cymene | 4,27 | 0,234 |
| C10H14 | p-Cymene | 4,527 | 0,2478 |
| C10H14 | p-Diethylbenzene | 4,503 | 0,2439 |
| C10H14 | 1,2,4,5-Tetramethylbenzene | 4,58 | 0,24 |
| C10H22 | Decane | 5,288 | 0,3051 |
| C10H22O | 1-Decanol | 5,745 | 0,2971 |
| C11H24 | Undecane | 6,088 | 0,3396 |
| C12H10 | Biphenyl | 4,716 | 0,213 |
| C12H26 | Dodecane | 6,914 | 0,3741 |
| C12H26O | 1-Dodecanol | 7,269 | 0,3598 |
| C13H12 | Diphenylmethane | 6,046 | 0,2798 |
| C13H28 | Tridecane | 7,794 | 0,4109 |
| C13H28O | 1-Tridecanol | 8,12 | 0,3942 |
| C14H30O | 1-Tetradecanol | 8,991 | 0,4289 |
| C15H32 | Pentadecane | 9,65 | 0,4857 |
Equation du viriel
En application du théorème du viriel énoncé par Rudolf Clausius en 1865, le facteur de compressibilité peut être représenté par un développement en série. Les paramètres de cette formulation sont nommés coefficient du viriel (par exemple: B1, B2, B3, ...).z : facteur de compressibilité
Vm: volume molaire du gaz
B2: second coefficient du viriel
B3: troisième coefficient du viriel
Le premier coefficient est égal à 1; les autres peuvent être déterminés expérimentalement, ou bien estimés à partir d'autres caractéristiques du gaz (température critique, pression critique, facteur acentrique, ...).
Bien que le nombre de coefficients du viriel n'est pas limité, les auteurs se limitent souvent au deuxième ou troisième.Le second coefficient peut être formulé, entre autres, en utilisant:
- les paramètres
de l'équation de Van der Waals:
B2 = b - a⁄ RT - la relation proposée par Wohl en
1929, en fonction des températures et pression critiques du gaz:
B2 = R Tc⁄ Pc (0,197 - 0,012Tr - 0,400Tr-1 - 0,146Tr-3,27) - la relation proposée par Tsonopoulos en 1974, en fonction
des températures , pression critiques et du facteur
acentrique "ω" du gaz:
B2 = R Tc⁄ Pc (B0 + ω B')
B0 = 0,1445 - 0,330Tr-1 - 0,1385Tr-2 - 0,0121Tr-3 - 0,000607Tr-8
B' = 0,0637 + 0,331Tr-2 - 0,423Tr-3 - 0,008Tr-8
Tr = T⁄ Tc
Equation de Redlich-Kwong (R-K)
z solution de:
avec:
z solution de:
avec:
En 1972 Giorgio Soave proposa d'introduire dans la relation le facteur acentrique "ω" représentant la non sphéricité des molécules. Cette relation devient l'équation de Redlich-Kwong-Soave (R-K-S ou S-R-K). La comparaison avec le diagramme universel de Nelson et Obert montre qu'elle est utilisable jusqu'a Pr=8 et Tr=3,5. Cependant autour du point critique et le long de l'isotherme Tr=1, l'erreur peut être très importante.
Autres corrélations
Pour les gaz industriels aux enjeux économiques importants,on peut trouver des tables de valeurs ou des corrélations spécifiques à chaque produit. Ces informations sont disponibles par exemple pour:- le gaz naturel (American Gas Association)
- l'air
- l'éthylène
- ...
Constante des gaz parfaits
La valeur de R (constante des gaz
parfaits) dépend des unités
utilisées:
| Pression | Volume | R |
|---|---|---|
| atmosphère | litre | 0,082 |
| bar | litre | 0,083145 |
| pascal | litre | 8314,5 |
| pascal | m3 | 8,3145 |
| bar | m3 | 8,3145∙10-5 |
| atmosphère | m3 | 8,2∙10-5 |
Masse volumique des gaz

au cours d'une transformation isentropique:

ρ : Masse volumique du gaz
z : Coefficient de compressibilité
M: Masse molaire de la substance
P: Pression absolue du gaz
T : Température absolue du gaz (K)
R : Constante des gaz parfaits
γ : Cp/Cv
La masse volumique d'un gaz est tirée de l'équation d'état. Elle ne dépend que de la masse molaire de la substance et des pressions et températures.
La compression ou la détente d'un gaz sans échange de chaleur, ne se produit pas à température constante. Le gaz comprimé s'échauffera, tandis que le gaz détendu se refroidira. La variation de température contribue également à la variation de pression. En l'absence de pertes ou de frottements (transformation isentropique), la pression du gaz suit la loi de Laplace:PVγ=constant
avec γ=Cp/Cv
Propriétés des mélanges de gaz
Pour le calcul du coefficient de compressibilité du mélange, on remplace les températures et pression critiques par des constantes pseudocritiques obtenues par la moyenne des constantes critiques pondérée par la fraction molaire ou volumique de chaque constituant.
Tc moy = ∑(Yi . Tci)
Pc moy = ∑(Yi . Pci)
Yi: fraction molaire ou volumique de chaque constituant du mélangeTci, Pci: valeurs critiques de chaque constituant du mélange.
Les valeurs moyennes obtenues n'ont aucune réalité physiques, mais conduisent à une valeur de z satisfaisante. Par contre elles peuvent s'éloigner considérablement de la valeur expérimentale du point critique du mélange.
Pour le calcul de la masse volumique du gaz, on remplace la masse molaire du gaz par une valeur moyenne des masses molaires pondérée par la fraction molaire ou volumique de chaque constituant.
Mmoy = ∑(Yi . Mi)
ou bien si seule la fraction massique Xi est connue:Mmoy = 1/∑(Xi / Mi)
Votre avis est précieux pour améliorer ce site.
Avez-vous trouvé cette page utile?